| Alfa-amilase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
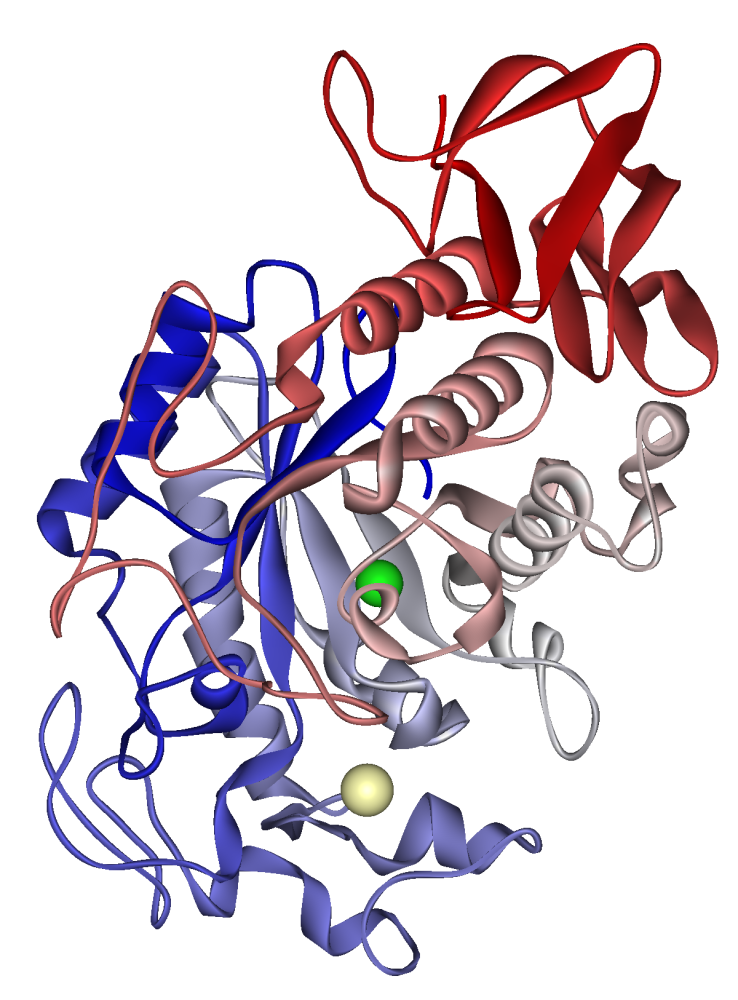
Alfa-amilase salivar humana: íon de cálcio visível em caqui pálido, íon de cloreto em verde. PDB 1SMD
|
|||||||||
| Identificadores | |||||||||
| Número EC | 3.2.1.0 | ||||||||
| Número CAS | 9000-90-2 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Visão IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | Visão NiceZyme | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
|
|||||||||
| Domínio catalítico GH13 | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Glicano transferase de ciclodextrina (e.c.2.4.1.19) (cgtase)
|
|||||||||
| Identificadores | |||||||||
| Símbolo | Alfa-amilase | ||||||||
| Pfam | PF00128 | ||||||||
| Clã Pfam | CL0058 | ||||||||
| InterPro | IPR006047 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
| Superfamília OPM | 117 | ||||||||
| Proteína OPM | 1wza | ||||||||
| CAZy | GH13 | ||||||||
| CDD | cd11338 | ||||||||
|
|||||||||
| Domínio de folha beta C-terminal da alfa-amilase | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Estrutura cristalina do isoenzima 1 de alfa-amilase de cevada (amy1) mutante inativo d180a em complexo com maltoheptaose
|
|||||||||
| Identificadores | |||||||||
| Símbolo | Alpha-amyl_C2 | ||||||||
| Pfam | PF07821 | ||||||||
| InterPro | IPR012850 | ||||||||
|
|||||||||
| Alfa-amilase, domínio all-beta C-terminal | |||||||||
|---|---|---|---|---|---|---|---|---|---|
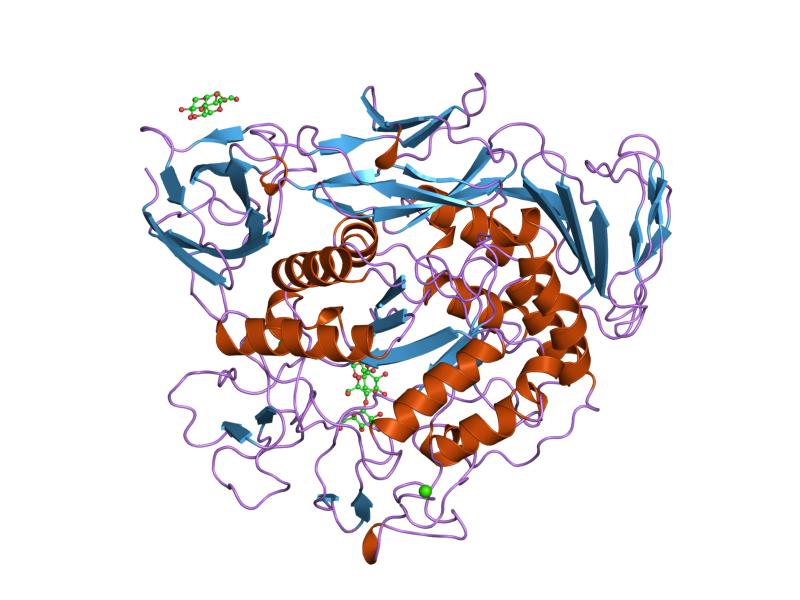
complexo de maltotriose de mutante de glicoziltransferase de ciclodextrina pré-condicionada
|
|||||||||
| Identificadores | |||||||||
| Símbolo | Alpha-amylase_C | ||||||||
| Pfam | PF02806 | ||||||||
| Clã Pfam | CL0369 | ||||||||
| InterPro | IPR006048 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
|
|||||||||
Alfa-amilase, (α-amilase) é uma enzima EC 3.2.1.1 que hidrolisa ligações alfa de grandes polissacarídeos com ligações alfa, como o amido e o glicogênio, resultando em cadeias mais curtas, dextrinas e maltose. É a forma predominante de amilase encontrada em humanos e outros mamíferos. Também está presente em sementes que contêm amido como reserva alimentar e é secretada por muitos fungos. É membro da família de hidrolases glicosídicas 13.
Na biologia humana
Embora seja encontrada em muitos tecidos, a amilase é mais proeminente no suco pancreático e na saliva, cada um dos quais possui sua própria isoforma de α-amilase humana. Elas se comportam de maneira diferente na eletroforese em gel, e podem também ser separadas em testes usando anticorpos monoclonais específicos. Nos humanos, todas as isoformas de amilase estão ligadas ao cromossomo 1p21 (veja AMY1A).
Amilase salivar (ptialina)
A amilase é encontrada na saliva e quebra o amido em maltose e dextrina. Esta forma de amilase também é chamada de “ptialina” /ˈtaɪəlɪn/, que foi nomeada pelo químico sueco Jöns Jacob Berzelius. O nome deriva da palavra grega πτυω (eu cuspo), porque a substância foi obtida da saliva. Ela quebrará grandes moléculas de amido insolúveis em amidos solúveis (amilodextrina, eritrodextrina e acrodextrina), produzindo sucessivamente amidos menores e, finalmente, maltose. A ptialina atua nas ligações glicosídicas α(1,4) lineares, mas a hidrólise de compostos requer uma enzima que atue em produtos ramificados. A amilase salivar é inativada no estômago pela acidez gástrica. No suco gástrico ajustado para pH 3,3, a ptialina foi totalmente inativada em 20 minutos a 37 °C. Em contraste, 50% da atividade da amilase permaneceu após 150 minutos de exposição ao suco gástrico a pH 4,3. Tanto o amido, o substrato para a ptialina, quanto o produto (cadeias curtas de glicose) são capazes de proteger parcialmente contra a inativação pela acidez gástrica. A ptialina adicionada a um tampão a pH 3,0 sofreu completa inativação em 120 minutos; no entanto, a adição de amido em um nível de 0,1% resultou em 10% da atividade restante, e adições semelhantes de amido em um nível de 1,0% resultaram em cerca de 40% da atividade restante em 120 minutos.
Condições ótimas para ptialina
- pH ótimo – 7.0
- Temperatura do corpo humano
- Presença de certos ânions e ativadores:
- Cloreto e brometo – mais eficazes
- Iodeto – menos eficaz
- Sulfato e fosfato – menos eficazes
Variação genética na amilase salivar humana
O gene da amilase salivar passou por duplicação durante a evolução, e estudos de hibridização de DNA indicam que muitos indivíduos possuem múltiplas repetições em tandem do gene. O número de cópias do gene correlaciona-se com os níveis de amilase salivar, conforme medido por ensaios de blot de proteína usando anticorpos para amilase humana. O número de cópias do gene está associado à aparente exposição evolutiva a dietas ricas em amido. Por exemplo, um indivíduo japonês tinha 14 cópias do gene da amilase (um alelo com 10 cópias e um segundo alelo com quatro cópias). A dieta japonesa tradicionalmente contém grandes quantidades de amido de arroz. Em contraste, um indivíduo Biaka carregava seis cópias (três cópias em cada alelo). Os Biaka são caçadores-coletores da floresta tropical que tradicionalmente consomem uma dieta de baixo teor de amido. Perry e colegas especularam que o aumento no número de cópias do gene da amilase salivar pode ter aumentado a sobrevivência coincidente com a transição para uma dieta rica em amido durante a evolução humana.
Amilase pancreática
A α-amilase pancreática cleva aleatoriamente as ligações glicosídicas α(1-4) da amilopectina para produzir dextrina, maltose ou maltotriose. Ela adota um mecanismo de deslocamento duplo com retenção da configuração anomérica. Nos humanos, a amilase salivar evoluiu a partir de uma cópia dela.
Na patologia
O teste para amilase é mais fácil de realizar do que o de lipase, tornando-se o teste primário usado para detectar e monitorar a pancreatite. Os laboratórios médicos geralmente medem a amilase pancreática ou a amilase total. Se apenas a amilase pancreática for medida, um aumento não será observado em casos de caxumba ou outro trauma das glândulas salivares.
No entanto, devido à pequena quantidade presente, a cronometragem é crítica ao coletar sangue para essa medição. O sangue deve ser coletado logo após um episódio de dor pancreática; caso contrário, é rapidamente excretado pelos rins.
A α-amilase salivar tem sido utilizada como um biomarcador de estresse e como um marcador substituto da atividade do sistema nervoso simpático (SNS) que não requer uma coleta de sangue.
Interpretação
Níveis plasmáticos aumentados em humanos são encontrados em:
- Trauma salivar (incluindo intubação anestésica)
- Caxumba – devido à inflamação das glândulas salivares
- Pancreatite – por causa do dano às células que produzem a amilase
- Insuficiência renal – devido à excreção reduzida
Leituras da amilase total superiores a 10 vezes o limite superior da normalidade (ULN) são sugestivas de pancreatite. Entre cinco e 10 vezes o ULN podem indicar íleo, doença duodenal ou insuficiência renal, e elevações mais baixas são comumente encontradas em doenças das glândulas salivares.
Genes
- salivar – AMY1A, AMY1B, AMY1C
- pancreática – AMY2A, AMY2B
Nos grãos
A atividade da α-amilase em grãos é medida, por exemplo, pelo Número de Queda de Hagberg–Perten, um teste para avaliar danos por brotação, ou pelo método Phadebas. Ocorre no trigo.
Uso industrial
A α-amilase é utilizada na produção de etanol para quebrar os amidos em grãos em açúcares fermentáveis.
O primeiro passo na produção de xarope de milho rico em frutose é o tratamento do amido de milho com α-amilase, produzindo cadeias mais curtas de oligossacarídeos açucarados.
Uma α-amilase chamada “Termamyl”, originada de Bacillus licheniformis, também é utilizada em alguns detergentes, especialmente detergentes para lavar louça e detergentes para remoção de amido.
Veja amilase para mais usos da família de amilases em geral.
Potencial para uso médico
A α-amilase demonstrou eficácia na degradação de biofilmes bacterianos polimicrobianos, hidrolisando as ligações glicosídicas α(1-4) dentro dos exopolissacarídeos estruturais da substância polimérica extracelular (EPS).
Inibição do tampão
A molécula de tris está reportada como inibidora de várias α-amilases bacterianas, portanto, não deve ser usada em tampão de tris.
Determinação
Vários métodos estão disponíveis para a determinação da atividade da α-amilase, e diferentes indústrias tendem a depender de métodos diferentes. O teste do iodo do amido, um desenvolvimento do teste do iodo, baseia-se na mudança de cor, já que a α-amilase degrada o amido e é comumente utilizada em muitas aplicações. Um teste similar, mas produzido industrialmente, é o teste de amilase Phadebas, que é utilizado como um teste qualitativo e quantitativo em várias indústrias, como detergentes, farinhas variadas, grãos e alimentos de malte, e biologia forense.
Arquitetura do domínio
As α-amilases contêm vários domínios de proteínas distintos. O domínio catalítico tem uma estrutura que consiste em um barril alfa/beta de oito fitas que contém o sítio ativo, interrompido por um domínio de ligação de cálcio de ~70 aminoácidos que se projeta entre a fita beta 3 e a hélice alfa 3, e um domínio em forma de chave grega C-terminal. Várias α-amilases contêm um domínio de fita beta, geralmente no terminal C. Este domínio é organizado como uma fita beta antiparalela de cinco fitas. Várias α-amilases contêm um domínio todo-beta, geralmente no terminal C.

