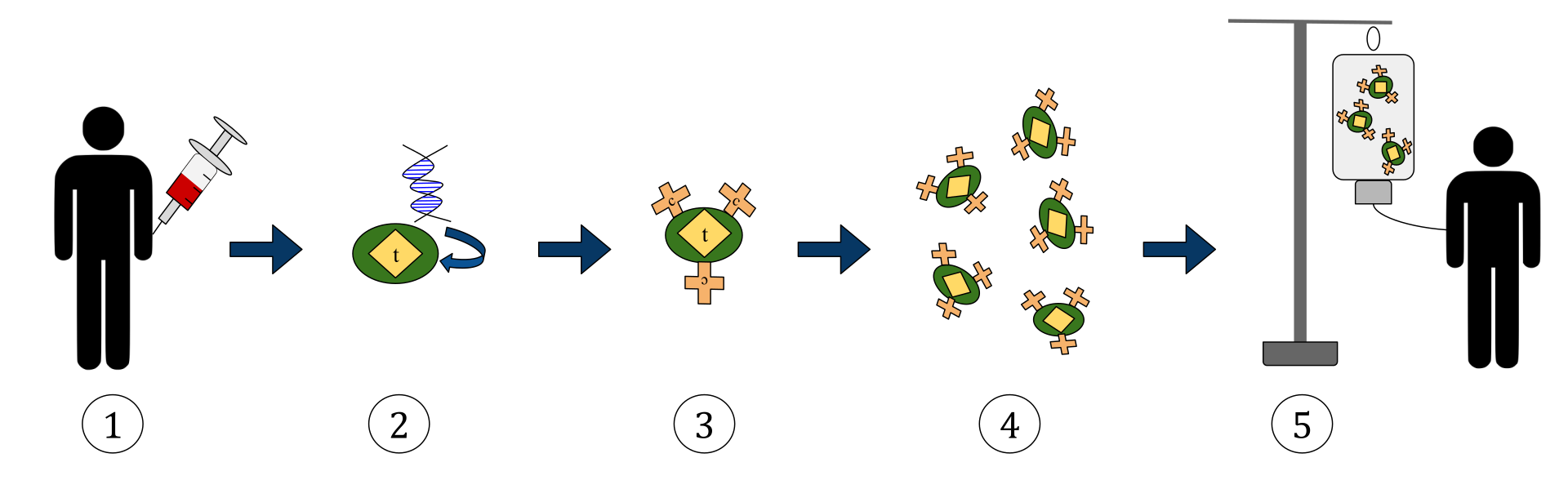
O diagrama acima representa o processo da terapia com células T com receptor de antígeno quimérico (CAR). Este é um método de imunoterapia, que é uma prática crescente no tratamento de câncer. O resultado final deve ser a produção de células T equipadas que podem reconhecer e combater as células cancerígenas infectadas no corpo.
1. As células T (representadas por objetos rotulados como ‘t’) são removidas do sangue do paciente.
2. Em seguida, em um ambiente de laboratório, o gene que codifica os receptores de antígeno específicos é incorporado nas células T.
3. Assim, são produzidos os receptores CAR (rotulados como c) na superfície das células.
4. As novas células T modificadas são então colhidas e cultivadas no laboratório.
5. Após um determinado período, as células T engenheiradas são infundidas novamente no paciente.
Células T com receptor de antígeno quimérico (também conhecidas como Células T CAR) são células T que foram geneticamente modificadas para produzir um receptor de células T artificial para uso em imunoterapia.
Os receptores de antígeno quimérico (CARs, também conhecidos como imunorreceptores quiméricos, receptores T celulares quiméricos ou receptores T celulares artificiais) são proteínas receptoras que foram projetadas para dar às células T a nova capacidade de direcionar uma proteína específica. Os receptores são quiméricos porque combinam funções de ligação ao antígeno e ativação de células T em um único receptor.
A terapia com células CAR-T utiliza células T engenheiradas com CARs para terapia do câncer. A premissa da imunoterapia CAR-T é modificar as células T para reconhecer as células cancerígenas a fim de direcioná-las e destruí-las de forma mais eficaz. Os cientistas colhem células T de pessoas, alteram-nas geneticamente e, em seguida, infundem as células CAR-T resultantes nos pacientes para atacar seus tumores. As células CAR-T podem ser derivadas das células T no sangue do próprio paciente (autólogos) ou das células T de outro doador saudável (alogênicos). Uma vez isoladas de uma pessoa, essas células T são geneticamente modificadas para expressar um CAR específico, que as programa para direcionar um antígeno presente na superfície dos tumores. Por motivos de segurança, as células CAR-T são projetadas para serem específicas a um antígeno expresso em um tumor que não é expresso em células saudáveis.
Após a infusão das células CAR-T em um paciente, elas atuam como um “remédio vivo” contra as células cancerígenas. Quando entram em contato com seu antígeno alvo em uma célula, as células CAR-T se ligam a ele e se ativam, prosseguindo para proliferar e se tornarem citotóxicas. As células CAR-T destroem células através de vários mecanismos, incluindo proliferação celular estimulada extensiva, aumentando o grau em que se tornam tóxicas para outras células vivas (citositicidade) e causando a secreção aumentada de fatores que podem afetar outras células, como citocinas, interleucinas e fatores de crescimento.
Produção de células CAR-T

O primeiro passo na produção de células CAR-T é a isolação das células T do sangue humano. As células CAR-T podem ser produzidas tanto do próprio sangue do paciente, conhecido como tratamento autólogo, quanto do sangue de um doador saudável, conhecido como tratamento alogênico. O processo de fabricação é o mesmo em ambos os casos; apenas a escolha do doador inicial de sangue é diferente.
Primeiro, leucócitos são isolados usando um separador de células sanguíneas em um processo conhecido como aferese de leucócitos. As células mononucleares do sangue periférico (PBMC) são então separadas e coletadas. Os produtos da aferese de leucócitos são transferidos para um centro de processamento celular. No centro de processamento celular, células T específicas são estimuladas para que proliferem ativamente e se expandam em grandes números. Para impulsionar sua expansão, as células T são geralmente tratadas com a citocina interleucina 2 (IL-2) e anticorpos anti-CD3.
As células T expandidas são purificadas e, em seguida, transduzidas com um gene que codifica o CAR engenheirado através de um vetor retroviral, tipicamente um gammaretrovírus integrador (RV) ou um vetor lentiviral (LV). Esses vetores são muito seguros na atualidade devido a uma deleção parcial da região U3. A nova ferramenta de edição gênica CRISPR/Cas9 foi recentemente usada em vez de vetores retrovirais para integrar o gene CAR em locais específicos no genoma.
O paciente passa por quimioterapia de linfodepleção antes da introdução das células CAR-T engenheiradas. A depleção do número de leucócitos circulantes no paciente aumenta o número de citocinas que são produzidas e reduz a competição por recursos, o que ajuda a promover a expansão das células CAR-T engenheiradas.
Aplicações clínicas
Em março de 2019, havia cerca de 364 ensaios clínicos em andamento globalmente envolvendo células CAR-T. A maioria desses ensaios tem como alvo cânceres hematológicos: as terapias CAR-T representam mais da metade de todos os ensaios para malignidades hematológicas. O CD19 continua sendo o antígeno alvo mais popular, seguido por BCMA (comumente expresso no mieloma múltiplo). Em 2016, estudos começaram a explorar a viabilidade de outros antígenos, como o CD20. Os ensaios para tumores sólidos são menos dominados por CAR-T, com cerca da metade dos ensaios baseados em terapia celular envolvendo outras plataformas, como células NK.
Câncer
Células T são geneticamente modificadas para expressar receptores de antígeno quiméricos especificamente direcionados aos antígenos nas células tumorais de um paciente, e são então infundidas no paciente, onde atacam e matam as células cancerígenas. A transferência adotiva de células T expressando CARs é uma terapia anti-câncer promissora, porque as células T modificadas por CAR podem ser projetadas para direcionar praticamente qualquer antígeno associado ao tumor.
A pesquisa inicial sobre células CAR-T se concentrou em cânceres hematológicos. Os primeiros tratamentos aprovados utilizam CARs que visam o antígeno CD19, presente em cânceres derivados de células B, como leucemia linfoblástica aguda (LLA) e linfoma difuso de células B grandes (DLBCL). Há também esforços em andamento para engenheirar CARs visando muitos outros antígenos de câncer hematológico, incluindo CD30 em linfoma de Hodgkin refratário; CD33, CD123 e FLT3 em leucemia mieloide aguda (LMA); e BCMA no mieloma múltiplo.
Os tumores sólidos apresentaram um alvo mais difícil. A identificação de bons antígenos tem sido desafiadora: tais antígenos devem ser altamente expressos na maioria das células cancerígenas, mas amplamente ausentes em tecidos normais. As células CAR-T também não são traficadas de forma eficiente para o centro das massas tumorais sólidas, e o microambiente tumoral hostil suprime a atividade das células T.
Doenças autoimunes
Embora a maioria dos estudos sobre células T CAR se concentre na criação de uma célula T CAR que possa erradicar uma determinada população celular (por exemplo, células T CAR que visam células linfomatosas), há outros usos potenciais para essa tecnologia. Células T também podem proteger os autoantígenos de reações autoimunes. Uma célula T reguladora equipada com um CAR poderia ter o potencial de conferir tolerância a um antígeno específico, algo que poderia ser utilizado em transplantes de órgãos ou em doenças reumáticas como o lúpus.
Segurança
Há efeitos colaterais graves que resultam da introdução de células CAR-T no corpo, incluindo síndrome de liberação de citocinas e toxicidade neurológica. Como é um tratamento relativamente novo, há poucos dados sobre os efeitos a longo prazo da terapia com células CAR-T. Ainda existem preocupações sobre a sobrevivência a longo prazo dos pacientes, bem como complicações na gravidez em pacientes do sexo feminino tratados com células CAR-T. A anafilaxia é um efeito colateral esperado, uma vez que o CAR é feito com um anticorpo monoclonal estrangeiro e, como resultado, provoca uma resposta imune.
A identificação incorreta “no alvo/off-tumor” ocorre quando a célula CAR-T reconhece o antígeno correto, mas o antígeno é expresso em tecido saudável e não patogênico. Isso resulta nas células CAR-T atacando tecido não tumoral, como células B saudáveis que expressam CD19. A gravidade desse efeito adverso pode variar desde a aplasia de células B, que pode ser tratada com infusões de suporte, até toxicidade extrema levando à morte.
Existe também a possibilidade improvável de que as células CAR-T engenheiradas se transformem em células cancerígenas por mutagênese de inserção, devido ao vetor viral inserindo o gene CAR em um supressor tumoral ou oncogene no genoma da célula T hospedeira. Alguns vetores retrovirais (RV) apresentam um risco menor do que vetores lentivirais (LV). No entanto, ambos têm o potencial de serem oncogênicos. A análise de sequenciamento genômico dos locais de inserção do CAR em células T foi estabelecida para melhor compreensão da função e persistência das células CAR T in vivo.
Síndrome de liberação de citocinas
A questão mais comum após o tratamento com células CAR-T é a síndrome de liberação de citocinas (CRS), uma condição na qual o sistema imunológico é ativado e libera um número aumentado de citocinas inflamatórias. A manifestação clínica dessa síndrome se assemelha a sepse, com febre alta, fadiga, mialgia, náusea, vazamentos capilares, taquicardia e outras disfunções cardíacas, falência hepática e comprometimento renal. A CRS ocorre em quase todos os pacientes tratados com terapia celular CAR-T; na verdade, a presença da CRS é um marcador diagnóstico que indica que as células CAR-T estão funcionando como pretendido para matar as células cancerígenas. No entanto, note que um grau mais elevado de gravidade da CRS não se correlaciona com uma resposta aumentada ao tratamento, mas sim com uma maior carga da doença.
Neurotoxicidade associada a células efetoras imunes
A toxicidade neurológica também está frequentemente associada ao tratamento com células CAR-T. O mecanismo subjacente é pouco compreendido e pode ou não estar relacionado à CRS. As manifestações clínicas incluem delírio, perda parcial da capacidade de falar de forma coerente, enquanto ainda se tem a capacidade de interpretar a linguagem (afasia expressiva), redução da alerta (obtundação) e convulsões. Durante alguns ensaios clínicos, ocorreram mortes causadas por neurotoxicidade. A principal causa de morte por neurotoxicidade é o edema cerebral. Em um estudo conduzido pela Juno Therapeutics, Inc., cinco pacientes inscritos no ensaio morreram em decorrência de edema cerebral. Dois dos pacientes foram tratados apenas com ciclofosfamida e os outros três foram tratados com uma combinação de ciclofosfamida e fludarabina. Em outro ensaio clínico patrocinado pelo Fred Hutchinson Cancer Research Center, houve um caso relatado de toxicidade neurológica irreversível e fatal 122 dias após a administração das células CAR-T.

